abstract
Această revizuire postulează și prezintă dovezi recente că rezistența la insulină este inițiată în țesutul adipos și sugerează, de asemenea, că țesutul adipos poate juca un rol cheie în inducerea rezistenței la insulină în mușchi și ficat. Tulburări semnificative în cascada de semnalizare a insulinei intracelulare sunt prezente în celulele adipoase ale pacienților cu diabet zaharat de tip 2, incluzând scăderea expresiei genei IRS-1 și a proteinelor, afectarea activității PI3-kinazei stimulată de insulină și activitatea PKB/Akt. În schimb, semnalizarea insulinei în amonte în mușchiul scheletic de la persoanele diabetice prezintă doar leziuni ușoare și activarea PKB/Akt in vivo de insulină pare normală. Cu toate acestea, transportul glucozei stimulat de insulină și sinteza glicogenului sunt reduse semnificativ.
Afectări marcate similare în semnalizarea insulinei, incluzând scăderea expresiei IRS-1, afectarea activității PI3-kinazei stimulate de insulină și activitatea PKB/Akt sunt de asemenea observate la unii indivizi normoglicemici (∼ 30%) cu predispoziție genetică la diabetul de tip 2. GLUT4 în aceste celule este semnificativ redus, ceea ce este similar cu cele observate în celulele diabetice. Persoanele cu expresie celulară scăzută a IRS-1 și GLUT4 sunt, de asemenea, puternic rezistente la insulină și prezintă mai multe caracteristici ale sindromului de rezistență la insulină.
Astfel, un tipar „diabetic” este observat și la celulele adipoase la subiecții normoglicemici, care este asociat cu o rezistență marcată la insulină in vivo. Se crede că rezistența la insulină și/sau efectorii săi sunt inițiați în adipocite și că aceasta poate fi secundară altor țesuturi țintă ale insulinei, inclusiv transportul afectat al glucozei în mușchi.
Estimarea sensibilității întregului corp la insulină și efectul metodei euglicemice este în principal o reflectare a defalcării glucozei pe mușchi (60-70%). Țesutul adipos reprezintă doar% 10% din totalul corpului și absorbția glucozei hepatice ∼ 30%. Eliminarea redusă a glucozei stimulată de insulină în timpul clampei euglicemice se datorează în principal absorbției scăzute a glucozei musculare. Acest lucru a dus la extrapolarea faptului că rezistența la insulină a întregului corp apare nu numai la nivelul mușchilor, ci și la nivelul mușchilor. Aceasta este o extrapolare nejustificată care ne poate conduce la căutarea incorectă a mecanismelor patogene.
Modelele animale, atât supraexprimarea transgenică, cât și eliminarea genelor, ne-au oferit perspective incitante asupra consecințelor fenotipice ale supraexprimării sau ablației genice specifice. Ablația genică a unor importante proteine de andocare IRS-1 și IRS-2 a produs animale retardate de creștere și marcat rezistente la insulină (IRS-1) 2 sau animale rezistente la insulină și diabetice cu secreție de insulină afectată (IRS-2). 3 Ablația GLUT4 musculară specifică duce la rezistență la insulină, 4 dar la fel ca knock-out-ul specific glut4 genocotic, de fapt cu ceea ce pare a fi similar. Această constatare este în mod clar incompatibilă cu rolul important al țesutului adipos în eliminarea glucozei din tot corpul. O altă descoperire interesantă la modelele animale este că epuizarea musculară GLUT4 este asociată cu o creștere semnificativă a absorbției de glucoză în grăsimi și a masei țesutului adipos extins. Această legătură între țesuturi susține posibilitatea ca rezistența la insulină să poată fi inițiată într-un țesut, urmată de o serie de evenimente în alte țesuturi/organe.
Această scurtă revizuire rezumă descoperirile noastre recente la om, care arată că rezistența la insulină și acțiunea afectată a insulinei apar inițial în țesutul adipos; de fapt, cu mult înainte de apariția intoleranței la glucoză. Se speculează apoi că țesutul adipos poate iniția și/sau poate fi organul țintă inițial pentru insulină în cazul în care se dezvoltă rezistența la insulină. Datele recente vor fi examinate în cazul în care semnalizarea și efectul insulinei au fost studiate în țesuturile țintă umane în condiții rezistente la insulină, în special în diabetul de tip 2. Deoarece nu se știe practic nimic despre semnalizarea insulinei din spatele receptorului de insulină din ficatul uman, nu se pot face comparații decât între mușchiul scheletic și celulele adipoase.
Diabetul de tip 2
Recent a fost investigat efectul insulinei, fie perfuzat in vivo, fie adăugat in vitro, asupra transportului glucozei și a semnalizării insulinei în mușchii scheletici de la pacienții cu diabet de tip 2. Cele mai semnificative constatări sunt fosforilarea IRS-1 stimulată de insulină stimulată de tirozină, care este asociată cu o reducere cu 50% a activității PI3-kinazei. Cu toate acestea, activarea în aval a serinei/treonin kinazei importante PKB/Akt pare normală sau numai în prezența unei concentrații suprapiziologice de insulină adăugată in vitro. Fosforilarea cu tirozină afectată nu pare a fi cauzată de scăderea expresiei proteinelor IRS-1, deși au fost observate niveluri mai scăzute în diabetul gestațional în unele celule. Creșterea fosforilării serinice a IRS-1 poate reduce fosforilarea tirozinei stimulată de insulină, dar în prezent nu se știe dacă acesta este cazul diabetului de tip 2. În general, datele sugerează că activarea PI3-kinazei și, eventual, PI3, 4 și generația de fosfat PI3, 4, 5, este redus, dar încă suficient pentru a permite activarea normală a evenimentelor de semnalizare în aval. Acest lucru a condus la concluzia că rezistența la insulină în mușchii scheletici se datorează activării afectate a efectorului sau a moleculelor de semnalizare de către PKB/Akt. 8
Transportul de glucoză stimulat de insulină este, de asemenea, redus la nivelul mușchilor scheletici la pacienții cu diabet zaharat de tip 2. 12 În mod surprinzător, însă, studii recente in vitro au arătat că acest lucru pare a fi în principal datorat „toxicității glucozei”. Preincubarea biopsiilor tisulare timp de doar 2 ore la niveluri ridicate de glucoză înrăutățește efectul insulinei, 13 în timp ce preincubarea mușchilor mușchilor diabetici timp de 2 ore la niveluri fiziologice de glucoză normalizează răspunsul la insulină. Cu toate acestea, este de asemenea posibil ca timpul de preincubare să depășească efectul altor antagoniști circulanți asupra efectului insulinei, cum ar fi TNFa, interleukinele și/sau acizii grași liberi (FFA). Datele disponibile în prezent sugerează că există doar tulburări modeste și aparent nu funcționale critice în semnalizarea insulinei pre-PKB/Akt în mușchii scheletici de la pacienții cu diabet de tip 2. În plus, transportul afectat de insulină stimulat de insulină pare a fi rapid reversibil in vitro prin preincubarea probelor de țesut în mediu proaspăt care conține glucoză fiziologică. Aceste constatări sunt, de asemenea, în concordanță cu dovezi consistente că atât conținutul de proteine GLUT4, cât și expresia ARNm sunt normale în mușchiul scheletic în diabetul de tip 2. 7, 16
Situația este complet diferită în țesutul adipos. Adipocitele de la pacienții cu diabet zaharat de tip 2 au, de asemenea, o reducere semnificativă a fosforilării tirozinei stimulate de IRS-1. Cu toate acestea, acest lucru se datorează în principal exprimării unei reduceri de 70% a expresiei proteinei IRS-1. În mod similar, activitatea totală a PI3-kinazei este redusă cu 70%. În schimb, expresia IRS-2 este normală și această moleculă devine, de asemenea, proteina de andocare majoră pentru activarea PI3-kinazei stimulată de insulină. 17 În concordanță cu scăderea activării PI3-kinazei, activarea PKB/Akt în aval este, de asemenea, redusă semnificativ, în principal datorită unei reduceri semnificative a fosforilării serinei stimulate de insulină. Transportul glucozei ca răspuns la insulină este, de asemenea, redus la celulele adipoase ale pacienților cu diabet zaharat de tip 2 din cauza insuficienței semnalizării insulinei, precum și a scăderii marcate (∼ 70-80%) a proteinelor GLUT4 și a expresiei ARNm. 17, 19, 20
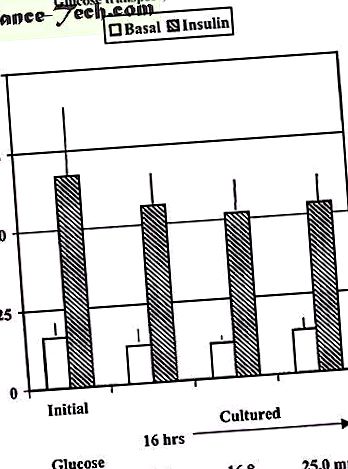
Spre deosebire de celulele musculare, așa cum s-a menționat mai sus, preincubarea celulelor adipoase umane timp de 16 ore la concentrații fiziologice (5,6 mmol/l) sau ridicate de glucoză (16, 8 și 25 mmol/l) nu interferează cu efectul stimulator acut al insulinei asupra glucozei (Figura 1) și nici preincubarea celulelor diabetice la concentrații fiziologice de glucoză nu restabilește răspunsul acut la insulină după 6 ore (observații nepublicate). Acest lucru este în concordanță cu expresia scăzută a proteinei GLUT4 în adipocite, care necesită probabil un timp de inversare mai lung.
Absorbția de glucoză prin explante umane de țesut adipos subcutanat înainte (inițială) sau după cultivare timp de 16 ore la 5, 6, 16, 7 sau 25,0 mM glucoză. După perioada de cultură, celulele izolate au fost incubate cu insulină 6,9 nM și 0,15 uCi [14CU] glucoză timp de 60 de minute pentru a determina absorbția glucozei. Datele sunt mijloace ± sem din patru experimente separate.
Imagine la dimensiune completă
Tabelul 1 rezumă principalele diferențe în evenimentele ascendente stimulate de insulină la mușchi și grăsime de la subiecții cu diabet zaharat de tip 2 comparativ cu pacienții fără diabet.
Tabel în dimensiune completă
Condiții normoglicemice, rezistente la insulină
Exprimarea proteinei IRS-1 în celulele grase ale indivizilor obezi sau rudelor sănătoase neobeze ale diabetului de tip 2. Date reproduse din Carvalho și colab. 28 cu permisiunea.
Imagine la dimensiune completă
Astfel, expresia scăzută a genei și proteinelor IRS-1 și GLUT4 este observată la celulele grase ale pacienților cu diabet de tip 2, precum și la un grup de indivizi sănătoși, în special cei cu o moștenire puternică pentru diabetul de tip 2. În aceste grupuri, în aval evenimentele de semnalizare sunt de asemenea afectate în mod similar.pentru insulină. Persoanele sănătoase cu aceste anomalii celulare sunt, de asemenea, puternic rezistente la insulină in vivo, au niveluri mai ridicate de insulină și de trigliceride la post, prezentând mai multe semne ale sindromului de rezistență la insulină (sau metabolism). În plus, faptul că acești indivizi au fost rezistenți la capacitatea insulinei de a stimula absorbția glucozei in vivo în timpul clemei euglicemice indică faptul că absorbția musculară a fost redusă, probabil din cauza transportului afectat al glucozei. 34
Este puțin probabil ca anomaliile moleculare observate în celulele adipoase să fie secundare rezistenței la insulină și hiperinsulinemie. Deși proteina IRS-1 poate fi redusă prin hiperinsulinemie severă și pe termen lung in vitro, 35 mulți indivizi obezi au avut atât hiperinsulinemie, cât și expresie normală a IRS-1. Scăderea expresiei GLUT4 nu poate fi explicată prin această posibilitate.
După cum s-a menționat mai sus, principala constatare consecventă în mușchi în diabetul de tip 2 pare a fi o tulburare (reversibilă rapid?) În transportul glucozei stimulat de insulină și sinteza glicogenului, în timp ce activarea PKB/Akt este normală. Deși acest lucru nu exclude anomalii majore în alte ținte moleculare încă nedefinite ale acțiunii insulinei în mușchi, cum ar fi proteina asociată c-Cbl (CAP) 36, este de asemenea clar că există diferențe mari între grăsime și mușchi în acest respect. Astfel, expresia scăzută a IRS-1 în adipocite este un biomarker al rezistenței la insulină și o tendință la diabetul de tip 2. 28
Întrebarea cheie, deci, este de ce există aceste diferențe în semnalizarea insulinei și expresia genelor și proteinelor între cele două țesuturi țintă majore ale insulinei. Deși nu există răspunsuri ferme la aceasta, o posibilitate este că țesutul adipos inițiază și/sau este țesutul inițial în care se dezvoltă rezistența la insulină. Acest lucru ar putea duce apoi la o serie de evenimente în care rezistența la insulină este indusă sau crescută în mușchi și ficat.
O posibilitate este că expresia scăzută a IRS-1 și GLUT4 în celulele adipoase duce la o reducere a sensibilității la insulină în tot corpul. După cum sa menționat mai sus, este puțin probabil ca o reducere a aportului relativ scăzut de glucoză adiposă (
Recent, s-a descoperit că țesutul adipos secretă o altă peptidă, rezistina 40, care poate fi asociată cu rezistența la insulină în obezitate. O proteină similară, numită FIZZ141, a fost anterior izolată din celulele inflamatorii din spălarea pulmonară de la animale cu astm indus experimental. Cu toate acestea, rolul general al rezistinei în rezistența la insulină umană este conjectural. Două studii recente nu au reușit să detecteze expresia rezistinei în celulele grase umane 42, 43, indiferent de gradul de obezitate 42 sau rezistența la insulină. 43
O altă posibilitate este că expresia scăzută a IRS-1 și GLUT4 în adipocite este asociată cu niveluri crescute de lipoliză și FFA circulant, care la rândul lor afectează acțiunea insulinei in vivo. Cu toate acestea, nivelurile de FFA în post la acești indivizi nu diferă de cele ale indivizilor atent asortați cu expresie normală a acestor proteine, dar se așteaptă ca capacitatea insulinei de a reduce nivelul FFA să fie afectată.
Deși există multe dovezi care să susțină transmiterea încrucișată endocrină între grăsime și mușchi (și ficat?), În prezent nu este clar cum un astfel de mecanism poate explica faptul că lipoatrofia este asociată și cu rezistența la insulină și diabet. Într-un model animal de lipoatrofie, sa constatat că rezistența la insulină se datorează, probabil, deficitului de leptină. Administrarea de leptină la aceste animale a îmbunătățit semnificativ sensibilitatea la insulină, probabil din cauza oxidării crescute a excesului de lipide acumulate în mușchi și alte țesuturi. În schimb, într-un alt model animal de lipoatrofie totală, leptina nu a reușit să îmbunătățească rezistența la insulină, dar transplantul de grăsime a dus la o îmbunătățire semnificativă. 46
Astfel, țesutul adipos produce nu numai peptide care pot induce rezistența la insulină, ci și hormoni care pot spori rezistența la insulină, cum ar fi leptina 45 și adiponectina. 47, 48, 49 Nivelurile adiponectinei circulante sunt corelate pozitiv cu sensibilitatea la insulină și sunt legate negativ de IMC. În plus, administrarea de adiponectină la modelele animale de rezistență la insulină și diabet îmbunătățește sensibilitatea la insulină. Astfel, echilibrul producției de hormoni ai țesutului adipos care îmbunătățește (cum ar fi IL-6 și TNFα) sau ameliorează (cum ar fi leptina și adiponectina) rezistența la insulină, precum și alte efecte, se datorează probabil mai multor factori, inclusiv masa de grăsime, starea nutrițională și fundalul genetic.
Efectele tiazolidindionelor asupra expresiei IRS-1 și IRS-2
Efectul pioglitazonei (10 μM) asupra expresiei mARN-ului IRS-2 în celulele adipoase de tip grăsime incubate timp de 16 ore, după cum se indică.
Imagine la dimensiune completă
IRS-2 este proteina de andocare majoră pentru activarea PI3-kinazei în adipocite atunci când IRS-1 este redus semnificativ, ca în diabetul de tip 2, 17, așa cum este descris mai sus. În mod similar, IRS-2 funcționează ca o proteină de andocare majoră în celulele animalelor IRS-1 „knock-out”. În plus, IRS-2 pare a fi molecula predominantă IRS exprimată în ficat și celulele β 3, 53, iar anomaliile din aceste organe par, de asemenea, să fie o cauză majoră a diabetului de tip 2 la lovirea animalelor IRS-2 '. Am examinat recent nivelurile celulare ale IRS-2 la animalele ob/ob tratate timp de 6 zile cu TZD și, de asemenea, am găsit o expresie crescută în celulele adipoase (observare nepublicată). Cu toate acestea, în prezent nu este clar dacă TZD crește, de asemenea, expresia IRS-2 în mușchi, ficat și celule β, dar acesta este subiectul unui studiu în curs.
Creșterea expresiei IRS-2 în grăsimi, ficat și/sau mușchi ar putea înlocui scăderea proteinelor IRS-1 și/sau afectarea fosforilării și activării insulinei, ducând la o sensibilitate crescută la insulină. În plus, creșterea prevăzută a expresiei IRS-2 în celulele β de către TZD poate fi importantă atât pentru creștere, cât și pentru funcție. Cu toate acestea, pare a fi o opțiune terapeutică atractivă de a avea agenți care cresc direct expresia IRS-1, deoarece această proteină de andocare este un activator major al PI3-kinazei ca răspuns la insulina din celulele grase umane și, spre deosebire de IRS-2, este rezistentă la IRS-1.insulina redusă semnificativ în adipocite. Sugerăm aici că reducerea specifică țesutului a expresiei genei și proteinelor IRS-1 și GLUT4 poate juca un rol important în dezvoltarea rezistenței la insulină a întregului corp, fie direct, fie indirect, prin asocierea cu producția crescută de citokine și/sau alți factori antagonisti ai insulinei. (Figura 4). TZD poate atenua sau normaliza acest efect prin creșterea expresiei IRS-2 în adipocite și, eventual, în alte țesuturi țintă pentru insulină și celule β pancreatice.
Succesiune potențială de evenimente în care țesutul adipos poate induce rezistență la insulină.
Imagine la dimensiune completă
Deși această revizuire se concentrează pe constatările recente privind rezistența la insulină la afectarea timpurie a semnalizării insulinei și acțiunea în adipocite prin expresia scăzută a IRS-1/GLUT4 și efectul TZD asupra IRS-1/IRS-2, TZD susține în mod clar și alte modificări importante. în țesutul adipos. Acestea includ recrutarea adipocitelor noi și mai mici prin creșterea adipogenezei, un proces în care atât IRS-1 cât și IRS-2 joacă un rol crucial 56, modificând expresia genelor direct sau indirect legată de acțiunea insulinei, 57 inclusiv inhibarea citokinelor de eliberare a adipocitelor. În plus, capacitatea TNFa de a stimula lipoliza și eliberarea FFA este, de asemenea, antagonizată de TZD. 38
Cu toate acestea, insulina este un regulator cheie al nivelurilor de lipoliză și al nivelurilor de FFA circulante in vivo, iar efectul antilipolitic al insulinei este mediat de activarea PI3-kinazei. Astfel, expresia scăzută a IRS-1 și activitatea PI3-kinazei stimulată de insulină va lega, de asemenea, rezistența la insulină, așa cum este definită prin absorbția redusă de glucoză stimulată de insulină, la capacitatea insuficientă a insulinei de a suprima lipoliza.
Mulțumiri
Studiile efectuate în laboratorul autorului au fost susținute de subvenții de la Consiliul Suedez pentru Cercetări Medicale (proiectul B-3506), Asociația Suedeză pentru Diabet, Comunitatea Europeană (QLG1-CT-1999-00674), Gullan și Sven-Erik Karlsson, Sony Hedenbratt Memorial Fund și Fundația IngaBritt și Arne Lundberg.
- Transformarea noii soții a lui Kollár în urmă cu 6 ani, el nu s-ar fi împiedicat de ea, așa arăta ea fără megapiere
- Aveți grijă la aragazul fierbinte, cuțitele ascuțite și căderile 13 sfaturi importante despre cum să protejați copiii de răniri
- Tulburare de panică și naștere
- Politick; atac lateral; și incl. ziu det; kol; k; Inainte de; kol; k
- Ardeii iute protejează împotriva infarctului - Om - Știință și tehnologie